هر آنچه باید درباره جدول تناوبی مندلیف بدانید

جدول تناوبی مندلیف یکی از مهمترین ابزارها در علم شیمی است که به ما کمک میکند تا عناصر شیمیایی را سازماندهی کنیم و ویژگیهای آنها را بهتر درک کنیم. در این مقاله، به بررسی جزئیات مختلف جدول تناوبی مندلیف، از جمله نام عناصر، خواص آنها، و نحوه طبقهبندی آنها خواهیم پرداخت، اما پیش از آن باید بدانیم جدول تناوبی چیست؟
جدول تناوبی مندلیف چیست؟
دیمیتری مندلیف و تاریخچه جدول تناوبی
جدول تناوبی بر چه اساسی طبقه بندی شده است؟
دوره و گروه در جدول تناوبی
جدول تناوبی دارای چند دوره است؟
جدول تناوبی دارای چند گروه است؟
فلزات و نافلزات جدول تناوبی مندلیف
ویژگی فلزات جدول تناوبی مندلیف
ویژگی نافلزات جدول تناوبی مندلیف
شعاع اتمی در جدول تناوبی
چطور جدول تناوبی مندلیف را حفظ کنیم؟
نام عناصر جدول تناوبی مندلیف به فارسی
جدول تناوبی مندلیف چیست؟
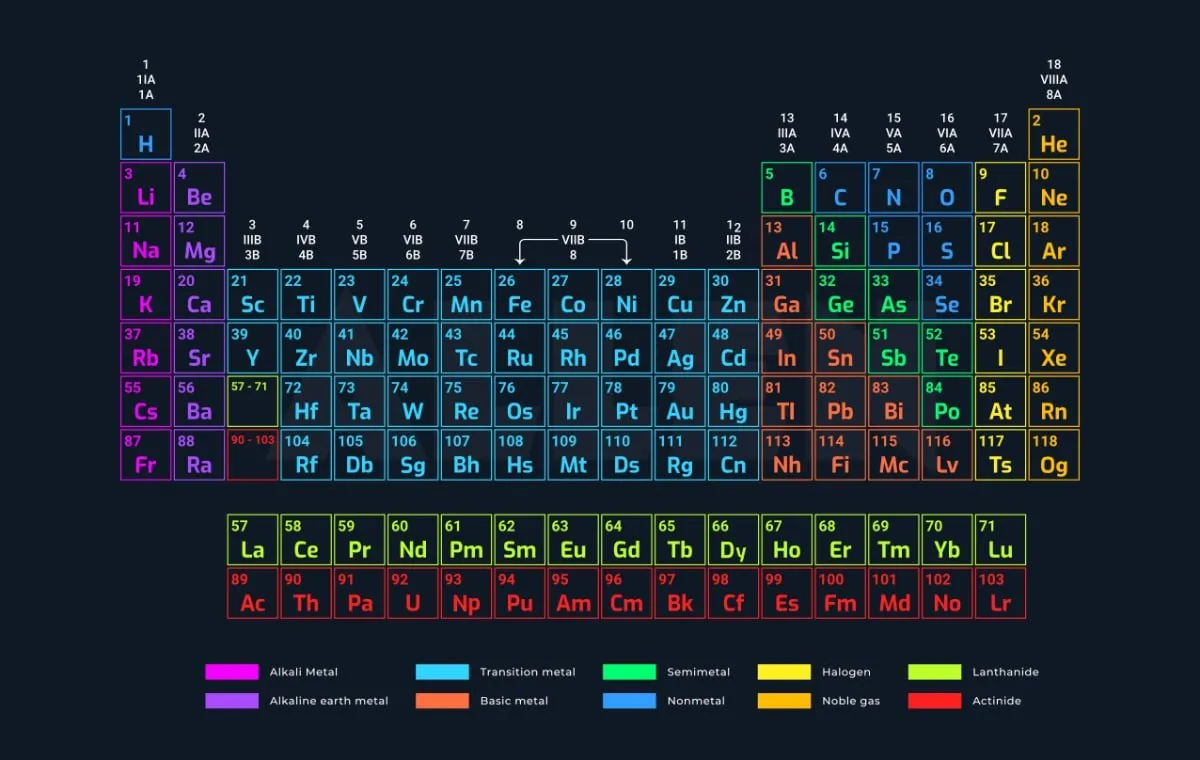
جدول تناوبی مندلیف، که به افتخار دیمیتری مندلیف، شیمیدان روسی، نامگذاری شده است، یک ساختار سازمانیافته است که عناصر شیمیایی را بر اساس خواص و ویژگیهای آنها مرتب میکند. این جدول به صورت مستطیلی طراحی شده و شامل دورهها و گروهها است که به شناسایی و مطالعه عناصر کمک میکند.
جدول تناوبی به ما این امکان را میدهد که الگوهای خاصی را در خصوص خواص شیمیایی و فیزیکی عناصر شناسایی کنیم. این جدول به عنوان یک ابزار آموزشی و مرجع برای شیمیدانان و دانشجویان شیمی بسیار مهم است. این جدول تا الان ۱۱۸ عنصر را در خود جای داده است.
تاکنون عنصرهای شیمیایی از عدد اتمی ۱ (هیدروژن) تا ۱۱۸ (اوگانسون) شناسایی یا ساخته شدهاند. دانشمندان هنوز به دنبال ساخت عناصر جدید جدول تناوبی پس از اوگانسون هستند و البته این پرسش را پیش رو دارند که عنصرهای تازهتر چگونه جدول را اصلاح خواهند کرد. همچنین ایزوتوپهای پرتوزای بسیاری هم در آزمایشگاه ساخته شده است.
دیمیتری مندلیف و تاریخچه جدول تناوبی
دیمیتری ایوانوویچ مندلیف، شیمیدان روسی، در تاریخ ۸ فوریه ۱۸۳۴ در سیبری روسیه به دنیا آمد. او در دانشگاه سنپترزبورگ تحصیل کرد و در آنجا به تدریس و تحقیق پرداخت. مندلیف به خاطر کارهایش در زمینه شیمی و به ویژه ایجاد جدول تناوبی عناصر شناخته میشود. این جدول به جدول دورانی عناصر هم شهرت دارد چون بر اساس دورههای مختلف و تکرار صفات عناصر تنظیم شده است. مندلیف در سال ۱۸۶۹ جدول تناوبی را طراحی کرد. او در ابتدا اطلاعات مربوط به عناصر موجود، از جمله جرم اتمی، خواص شیمیایی و فیزیکی عناصر را جمعآوری کرد و به دنبال راه مناسب و بهینهای برای دستهبندی آنها میگشت.
او در ابتدا عناصر را بر اساس جرم اتمی (از کم به زیاد) در یک جدول قرار داد. با این کار، او متوجه شد که عناصر با خواص مشابه در ستونهای عمودی قرار میگیرند. در واقع مندلیف متوجه شد که خواص عناصر به صورت دورهای تکرار میشوند. بنابراین او جدول را به گونهای طراحی کرد که این تکرارها را بهتر نشان دهد و توانست به چیزی شبیه به جدول تناوبی امروزی دست پیدا کند.
یکی از بزرگترین دستاوردهای مندلیف این بود که توانست خواص عناصر ناشناخته را پیشبینی کند. برای مثال، او پیشبینی کرد که باید عناصری مانند گالیم و ژرمانیوم وجود داشته باشند و خواص آنها را توصیف کرد، در حالی که در زمان او هنوز این عناصر کشف نشده بودند. زمانی که این عناصر جدید کشف شدند، مندلیف جدول خود را اصلاح کرد و به این ترتیب، جدول به یک ابزار مهم در علم شیمی تبدیل شد.

جدول تناوبی بر چه اساسی طبقه بندی شده است؟
اگر ندانید که جدول تناوبی چیست، احتمال این را هم نمیدانید که جدول بر چه اساسی طبقه بندی شده است. جدول تناوبی بر اساس عدد اتمی عناصر طبقه بندی شده است. عدد اتمی نشاندهنده تعداد پروتونها در هسته اتم است و این عدد به ترتیب افزایش در جدول قرار گرفته است. همچنین، خواص شیمیایی و فیزیکی عناصر نیز در این طبقه بندی نقش دارند.
علاوه بر عدد اتمی، جدول همچنین بر اساس خواص مشابه عناصر در گروهها و دورهها ترتیب داده شده است. به عنوان مثال، عناصر گروه یک (فلزات قلیایی) همه دارای یک الکترون در لایه بیرونی خود هستند و به همین دلیل رفتار مشابهی در واکنشهای شیمیایی دارند.
دوره و گروه در جدول تناوبی
همانطور که گفته شد، در جدول تناوبی، عناصر بر اساس ویژگیهای شیمیایی و فیزیکی خود دستهبندی میشوند. دو مفهوم کلیدی در این دستهبندی، دوره و گروه در جدول هستند. در ادامه به توضیح این دو مفهوم میپردازیم.
دورهها سطرهای افقی در جدول هستند. هر دوره نشاندهنده یک سطح انرژی جدید برای الکترونها است. هر دوره از چپ به راست با افزایش تعداد پروتونها و الکترونها پیش میرود و عناصر در یک دوره معمولاً ویژگیهای شیمیایی متفاوتی دارند. به عنوان مثال، یک دوره از فلزات قلیایی در سمت چپ شروع میشود و به گازهای نجیب در سمت راست میرسد.
گروهها ستونهای عمودی جدول هستند. هر گروه شامل عناصری است که ویژگیهای شیمیایی مشابهی دارند. عناصر در یک گروه معمولاً تعداد الکترونهای والانس مشابهی دارند که باعث مشابهت در رفتار شیمیایی آنها میشود. به عنوان مثال، گروه یک شامل فلزات قلیایی (مثل لیتیوم، سدیم و پتاسیم) است که همگی خواص مشابهی دارند.
در هر دوره، با پیشرفت از چپ به راست، ویژگیهای شیمیایی عناصر تغییر میکند. به طور کلی، خاصیت فلزی کاهش مییابد و خاصیت غیر فلزی افزایش مییابد. عناصر در یک گروه معمولاً رفتار مشابهی در واکنشهای شیمیایی دارند. به عنوان مثال، همه عناصر گروه ۱۷ (هالوژنها به معنای نمکزا) تمایل به تشکیل نمک دارند. درک دورهها و گروهها در جدول تناوبی به شما کمک میکند تا رفتار و ویژگیهای عناصر را بهتر درک کنید و ارتباطات بین آنها را شناسایی کنید. با همه اینها آیا میدانید جدول دارای چند دوره است و همچنین اینکه جدول دارای چند گروه است؟
جدول تناوبی دارای چند دوره است؟
جدول تناوبی شامل ۷ دوره است. هر دوره نشاندهنده تعداد لایههای الکترونی است که در اتمهای عناصر آن دوره وجود دارد. به عنوان مثال، عناصر دوره اول تنها یک لایه الکترونی دارند، در حالی که عناصر دوره آخر ۷ لایه الکترونی دارند. این تقسیمبندی به ما کمک میکند تا رفتار الکترونها و ویژگیهای شیمیایی عناصر را بهتر درک کنیم.
جدول تناوبی دارای چند گروه است؟
جدول تناوبی همچنین شامل ۱۸ گروه است. هر گروه شامل عناصری است که ویژگیهای شیمیایی مشابهی دارند. به عنوان مثال، عناصر گروه یک (فلزات قلیایی) همه دارای یک الکترون در لایه بیرونی خود هستند و ویژگیهای مشابهی از خود نشان میدهند. این ویژگیها باعث میشود که عناصر در یک گروه رفتار مشابهی در واکنشهای شیمیایی داشته باشند.
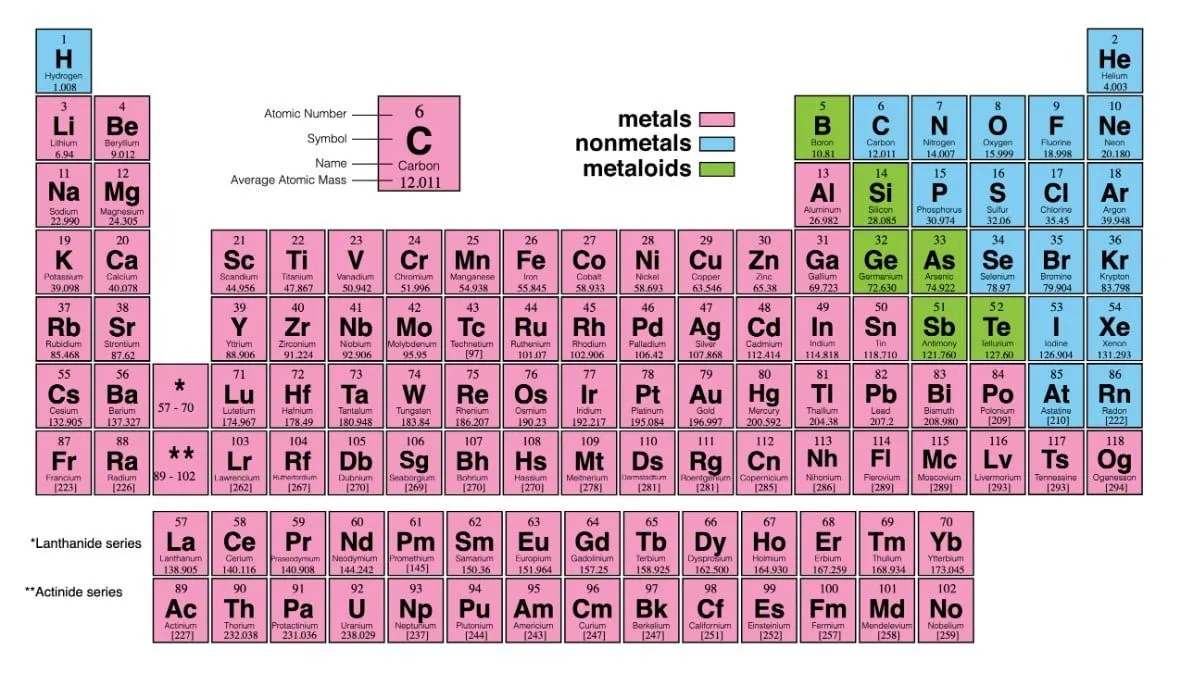
فلزات و نافلزات جدول تناوبی مندلیف
جدول به دو دسته اصلی تقسیم میشود: فلزات و نافلزات جدول تناوبی. فلزات در این جدول به طور کلی در سمت چپ و مرکز قرار دارند و دارای ویژگیهای خاصی هستند. این ویژگیها شامل موارد زیر است.
ویژگی فلزات
رسانایی الکتریسیته و حرارت: فلزات به خوبی الکتریسیته و حرارت را هدایت میکنند. این ویژگی به دلیل وجود الکترونهای آزاد در ساختار آنها است.
شکلپذیری و چکشخواری: فلزات میتوانند به راحتی تحت فشار شکل بگیرند و به صورت ورقهای نازک یا سیمهای نازک درآیند. این ویژگی به آنها اجازه میدهد که در صنایع مختلف مورد استفاده قرار گیرند.
براق بودن: فلزات معمولاً دارای سطح براق و درخشان هستند که باعث میشود در صنعت جواهرسازی و دکوراسیون هم مورد توجه قرار گیرند.
نقطه ذوب و جوش بالا: بیشتر فلزات دارای نقطه ذوب و جوش بالایی هستند که آنها را برای استفاده در شرایط سخت و دماهای بالا مناسب میسازد.

گروهی از زنان شیمیدان در دانشگاه اوهایو با تصویری از نمونه اولیه جدول تناوبی (معروف به جدول نوستراند) در پشت سرشان
ویژگی نافلزات
نافلزات در جدول معمولاً در سمت راست قرار دارند و ویژگیهای آنها با فلزات متفاوت است. ویژگیهای نافلزات شامل موارد زیر است:
عدم رسانایی الکتریسیته: اکثر نافلزات به خوبی الکتریسیته را هدایت نمیکنند و به همین دلیل در صنایع الکتریکی به عنوان عایق استفاده میشوند.
شکنندگی: نافلزات معمولاً شکننده هستند و نمیتوانند به راحتی شکل بگیرند یعنی به هنگام تغییر شکل دادن میشکنند.
عدم براق بودن: بیشتر نافلزات دارای سطح براق نیستند و به صورت مات دیده میشوند.
نقطه ذوب و جوش پایین: بسیاری از نافلزات دارای نقطه ذوب و جوش پایینی هستند که آنها را برای استفاده در دماهای پایین مناسب میسازد.
شعاع اتمی در جدول تناوبی
شعاع اتمی یکی از ویژگیهای مهم عناصر است که به اندازه و فاصله الکترونها از هسته اتم اشاره دارد. شعاع اتمی معمولاً به دو دسته تقسیم میشود: شعاع اتمی کاتیونی، که این شعاع در اثر از دست دادن الکترونها در کاتیونها کاهش مییابد و شعاع اتمی آنیونی، که این شعاع در اثر اضافه شدن الکترونها در آنیونها افزایش مییابد.
شعاع اتمی در جدول به طور کلی از بالا به پایین افزایش مییابد و از چپ به راست کاهش مییابد. این موضوع به دلیل افزایش تعداد لایههای الکترونی و همچنین افزایش بار مثبت هسته در عناصر است.

جدول تناوبی عناصر مندلیف به عنوان نقاشی دیواری در نمای انستیتوی مترولوژی مندلیف در سن پترزبورگ
چطور جدول تناوبی مندلیف را حفظ کنیم؟
برای حفظ کردن جدول تناوبی مندلیف، میتوان به روشهای مختلفی اشاره کرد. در ادامه به بررسی این روشها میپردازیم:
۱. درک ساختار جدول
عناصر و گروهها: جدول از سطرها (دورهها) و ستونها (گروهها) تشکیل شده است. درک اینکه عناصر مشابه در یک گروه ویژگیهای مشابهی دارند، میتواند به یادآوری کمک کند.
تعداد پروتونها: هر عنصر دارای تعداد مشخصی پروتون است که معینکننده آن عنصر است. به خاطر سپردن ترتیب عناصر بر اساس تعداد پروتونهایشان میتواند مفید باشد.
۲. استفاده از تکنیکهای یادآوری
مقایسه و ارتباط: سعی کنید عناصر را با چیزهای آشنا و روزمره مقایسه کنید. مثلاً، میتوانید نام عناصر را با غذاها، حیوانات یا شخصیتهای مشهور مرتبط کنید.
آموزش به دیگران: یکی از بهترین روشها برای یادگیری، آموزش به دیگران است. سعی کنید اطلاعات خود را به دوستان یا همکلاسیهایتان منتقل کنید.
۳. تمرین و تکرار
کارتهای حافظه: از کارتهای حافظه برای تمرین و مرور استفاده کنید. روی یک طرف کارت نام عنصر و روی طرف دیگر نماد و ویژگیهای آن را بنویسید.
پرسش و پاسخ: با خودتان یا دیگران پرسش و پاسخ کنید. این کار به شما کمک میکند تا اطلاعات را بهتر در ذهنتان نگه دارید.
در ادامه نام عناصر جدول تناوبی مندلیف به فارسی آمده است و میتوانید ببینید کدام عناصر نام فارسیشان با نام بینالمللیشان متفاوت است.
نام عناصر جدول به فارسی
جدول مندلیف شامل ۱۱۸ عنصر شیمیایی است که هر یک نام خاصی دارند. در این بخش، به معرفی نام عناصر جدول تناوبی به فارسی میپردازیم؛ نام عناصر جدول به ترتیب عدد اتمی از راست به چپ از این قرار است:
| هیدروژن (H) | هلیوم (He) | لیتیوم (Li) | بریلیوم (Be) | بور (B) | کربن (C) | نیتروژن (N) | اکسیژن (O) | فلور (F) | نئون (Ne) |
| سدیم (Na) | منیزیم (Mg) | آلومینیوم (Al) | سیلیکون (Si) | فسفر (P) | گوگرد (S) | کلر (Cl) | آرگون (Ar) | پتاسیم (K) | کلسیم (Ca) |
| اسکاندیم (Sc) | تیتانیوم (Ti) | وانادیوم (V) | کروم (Cr) | منگنز (Mn) | آهن (Fe) | کبالت (Co) | نیکل (Ni) | مس (Cu) | روی (Zn) |
| گالیم (Ga) | ژرمانیوم (Ge) | آرسنیک (As) | سلنیوم (Se) | برم (Br) | کریپتون (Kr) | روبیدیم (Rb) | استرانسیم (Sr) | یوتیوم (Y) | زیرکونیوم (Zr) |
| نایوبیوم (Nb) | مولیبدن (Mo) | تکنسیوم (Tc) | روتنیم (Ru) | پالادیوم (Pd) | نقره (Ag) | کادمیوم (Cd) | ایندیم (In) | قلع (Sn) | آنتیموان (Sb) |
| تلوریم (Te) | ید (I) | زنون (Xe) | سیزیم (Cs) | باریم (Ba) | لانتان (La) | سریم (Ce) | پرسیودیمیم (Pr) | نئودیمیم (Nd) | پرومتیوم (Pm) |
| ساماریوم (Sm) | یوروپیم (Eu) | گادولینیوم (Gd) | تریوم (Tb) | دیسپرزیوم (Dy) | هولمیوم (Ho) | ایتریوم (Er) | تالیوم (Tm) | لوتسیوم (Lu) | هافنیم (Hf) |
| تانتالم (Ta) | وولفرام (W) | رنیوم (Re) | اسمیم (Os) | ایریدیوم (Ir) | پلاتین (Pt) | طلا (Au) | جیوه (Hg) | تالیوم (Tl) | سرب (Pb) |
| بیسموت (Bi) | پولونیوم (Po) | آستاتین (At) | رادون (Rn) | فرانسیوم (Fr) | رادیوم (Ra) | اکتیوم (Ac) | توریم (Th) | پروتاکتینیوم (Pa) | اورانیوم (U) |
| نپتونیوم (Np) | پلوتونیوم (Pu) | امریکیم (Am) | کوریوم (Cm) | رکلیوم (Bk) | کالیفرنیم (Cf) | اینشتینیوم (Es) | فرمیوم (Fm) | ماندلیوم (Md) | نوبلیوم (No) |
| لورنسیم (Lr) | رادیم (Rf) | دوبنیم (Db) | سیبورگیم (Sg) | بوریوم (Bh) | هاسیم (Hs) | مایتنیم (Mt) | دارمشتادیم (Ds) | رُنتگنیوم (Rg) | کپنهاگن (Cn) |
| نیهونیم (Nh)، | فلرواسمیوم (Fl) | موسکوویوم (Mc) | لیورموریوم (Lv) | تنیسین (Ts) | اوگانسون (Og) |
در نهایت باید گفت جدول تناوبی مندلیف یک ابزار اساسی در علم شیمی است که به ما کمک میکند تا عناصر و خواص آنها را درک کنیم. با درک بهتر این جدول، میتوانیم به تحلیل و پیشبینی رفتار شیمیایی عناصر بپردازیم. جدول نه تنها یک ساختار ساده از عناصر شیمیایی است، بلکه یک دنیای پیچیده و جذاب از علم است که به ما کمک میکند تا به درک عمیقتری از مواد و ترکیبات پیرامون خود برسیم.
منبع: Britannica





