ایمونوتراپی چیست و چه فایدهای در علوم پزشکی دارد؟
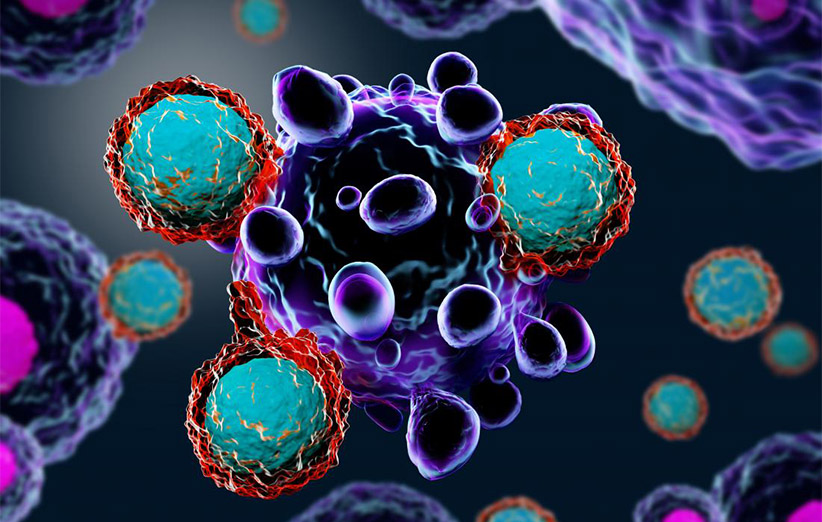
ایمونوتراپی که به اسم بیولوژی تراپی هم در برخی از متون شناخته میشود، یک فرایند درمانی مهم برای بسیاری بیماریها از جمله سرطان به حساب میآید. به طور کلی در ایمونوتراپی، دستگاه ایمنی بدن انسان سرکوب یا در برخی از سناریوها فعالتر میشود. با این حال، معمولا در ایمونوتراپیهای متداول در سراسر جهان، پزشکان در تلاش هستند با بهرهگیری از استراتژی صحیح، دستگاه ایمنی بدن بیمار را به طور موقت سرکوب کرده تا داروهای مورد نظر دیگر توان اثرگذاری داشته باشند. برای درمان انواع و اقسام سرطانها از ایمونوتراپی استفاده میشود. در این مطلب ضمن معرفی جامع اما خلاصهوارِ مفاهیم ایمونوتراپی، پیرامون آثار مثبت و منفی این فرایند درمانی هم صحبت میشود.
ایمونوتراپی به فرایندهای درمانی گفته می شود که سیستم ایمنی بدن خودِ بیمار برای مبارزه با یک بیماری خاص تحریک یا سرکوب میشود. متخصصین حوزهی درمان سرطان، استفاده از ایمونوتراپی را یکی از گزینههای روی میزِ بسیار خوب تلقی میکنند.
ایمونوتراپی به روشهای مختلف به بیمار سود میرساند. برخی از پروسههای درمانی به منظور تقویت سیستم دفاعی دستگاه ایمنی بدن مورد استفاده قرار میگیرند. در حالیکه سایر روشهای ایمونوتراپی به این منظور اجرا میشوند تا به دستگاه ایمنی در شناسایی و حمله به سلولهای سرطانی کمک کنند. دستگاه ایمنی شامل مجموعهای از اندامها، سلولهای تخصص یافته و مولکولهایی است که بدن موجود زنده را در برابر عفونتهای خارجی و عوامل بیماریزا محافظت میکند. ایمونوتراپی برخلاف متد کاری سادهاش روی کاغذ، یک فرایند به شدت پیچیده تلقی میشود؛ چراکه برخی از عوامل بیماریزا و سلولهای سرطانی این قدرت را دارند تا خود را از دید اجزای دستگاه ایمنی بدن مخفی کنند. این ویژگی رفتاری سلولها موجب میشود تا دستگاه ایمنی بدن تصور کند که عوامل بیماریزا، سلولهای خودی بوده و به همین دلیل، به آنها حمله نمیکند.
انواع ایمونوتراپی
ایمونوتراپی بر اساس سن، جنس، وخامت بیماری و سایر عوامل دیگر به شیوهای متفاوت در بدن فرد بیمار نتیجه خواهد داد. با این اوصاف، ایمونوتراپی چند نوع مختلفی دارد.
واکسنهای سرطان
واکسنهایی به بیماران تزریق میشود تا جلوی پیشرفت سرطان در بدن این دسته از بیماران تا حد بهسزایی گرفته شود. این دسته از واکسنها همچنین با تقویت و بهینهسازی پاسخ دستگاه ایمنی بدن به برخی از تومورها برای درمان سرطان سودمند خواهند بود. مثالهایی از واکسنهای این چنینی برای مقابله با پیشرفت سرطان، واکسنهایی است که جلوی عفونت ناشی از ویروس پاپیلومای انسانی (HPV) را میگیرد. ویروس HPV این قدرت را دارد تا سرطان گردن رحم و سایر سرطانها مثل حلق و دهان را در بدن فرد بیمار ایجاد کند.
اولین واکسن سرطانی در حیطهی ایمونوتراپی تحت عنوان پرووِنج (Provenge) در سال ۲۰۱۰ میلادی توسط سازمان غذا و داروی کشور ایالات متحدهی آمریکا (FDA) مورد تایید قرار گرفت
اولین واکسن سرطانی در حیطهی ایمونوتراپی تحت عنوان پرووِنج (Provenge) در سال ۲۰۱۰ میلادی توسط سازمان غذا و داروی کشور ایالات متحدهی آمریکا (FDA) مورد تایید قرار گرفت. واکسن پروونج با این هدف طراحی شد تا پاسخ دستگاه ایمنی علیه سرطان پروستاتِ متاستازی تحریک شود. از نکات مهم دربارهی این واکسن میتوان به منحصر به فرد بودن واکسن برای هر بیمار اشاره کرد. به زبان بسیار ساده، واکسن پروونج برای هر بیمار به شیوههای مختلف شخصیسازی میشود. بنابراین، در آیندهی نزدیک میتوان انتظار داشت که برای هر بیمار سرطانی، یک نوع خاصی از واکسن سرطان تهیه شود.
محققین در سراسر جهان در تلاش هستند تا واکسنهای مختلفی را برای درمان سرطانهای مختلف نظیر تومورهای مغزی، ملانوما، سرطان سینه، کلیه، لوکمیا و سایرین مورد بررسی قرار دهند. واکسنهای سرطان در کنار سایر پروسههای درمانی میتوانند نسبت به سایر روشهای ایمونوتراپی، اثرگذاری به مراتب بیشتری برای درمان سرطان داشته باشد.
آنتیبادیهای مونوکلونال
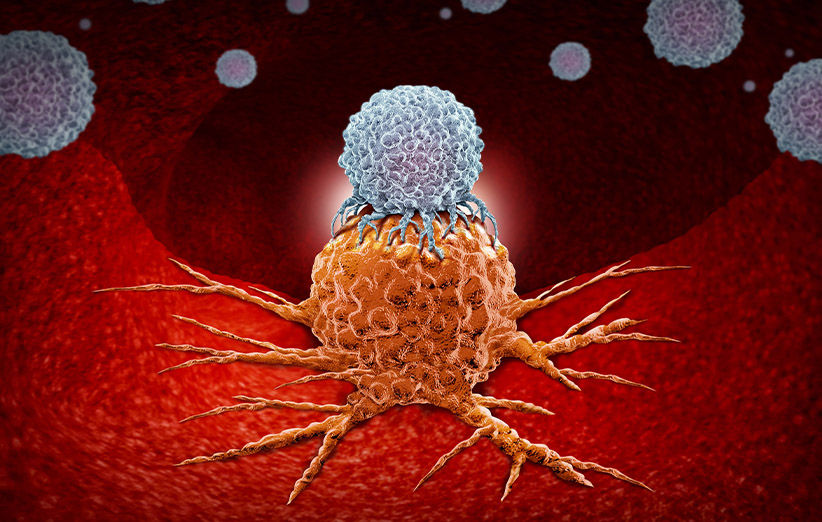
آنتیبادی، ایمونوگلوبولین یا پادتن، یک جزء مهم در دستگاه ایمنی است که وظیفهی شناسایی و خنثیسازی عوامل خارجی مثل باکتریهای بیماریزا و ویروسها را برعهده دارد. به عوامل بیماریزا به زبان ایمنیشناسی، آنتیژن (Antigen) گفته میشود. در حقیقت آنتیبادیها جایگاهی برای شناسایی آنتیژنها در ساختار خود دارند. لازم به ذکر است هر آنتیبادی، تنها آنتیژنهای خاصی را میتواند شناسایی کند. پس از اتصال آنتیژن به جایگاه خود در آنتیبادیها، در مرحلهی بعد آنتیبادیها سلولهای دیگری را فراخوانی کرده تا به سلولهای غیر طبیعی یا عوامل بیماریزا حمله کنند.
محققین میتوانند آنتیبادیهای شبیه به یکدیگر و همسان را در محیط آزمایشگاهی خلق کرده و برای درمان بیماران سرطانی از آنها استفاده کنند. این نوع آنتیبادیها را آنتیبادیهای مونوکلونال (Monoclonal antibodies) مینامند. آنتیبادیهای مونوکلونال میتوانند به منظور مسدودسازی عواملی به اسم مولکولهای چکپوینت نظیر CTLA-4، PD-1 و PD-L1 مورد استفاده قرار گیرند. این پروسه در آنتیبادیهای مونوکلونال موجب میشود تا سلولها خیلی قویتر از حالت طبیعی سلولهای توموری را از بین ببرند. سایر مولکولهای آنتیبادی مونوکلونال به آنتیژنها متصل شده و آنها را بلوکه میکنند. این دسته از آنتیژنها برای رشد و گسترش سلولهای سرطانی حیاتی هستند. برخی دیگر از آنتیبادیهای مونوکلونال یک مادهی رادیواکتیو، دارو یا یک سم مهلک را در خود داشته که میتوانند از این طریق، سلولهای سرطانی را تخریب کنند.
سلول درمانی
در این روش، سلولهای انسانی سالم به سلولهای بیمار انتقال یافته تا کارکرد آنها حفظ شود یا اگر فعالیت سلولی دچار نقص شده، با این روش بهبود یابد. پیوند سلولهای بنیادی و پروسهی درمانی تحت عنوان CAR T-Cell therapy از نمونههای بارز در این روش است. سلولهای T توانایی مبارزه با سلولهای سرطانی را به واسطهی ایجاد ایمنی سلولی دارد. همچنین در یکی دیگر از استراتژیهای جدید میتوان سلولهای بنیادی را به بافت آسیب دیده پیوند زد تا پروسهی ترمیم صورت گیرد.
سلول درمانی از قرن نوزدهم آغاز شد؛ درست زمانیکه محققین روی مدلهای حیوانی متمرکز شده بودند تا جلوی ابتلا به یک بیماری گرفته یا حتی یک اختلال درمان شود. با وجود اینکه در ابتدای امر هیچ تاثیر مثبتی از بابت مطالعات حاصل نشد، تحقیقات بیشتر در اواسط قرن بیستم موجب شد تا از سلولهای انسانی به شیوهای بهتر استفاده شود. در این بحبوحه، از سلولهای انسانی بهرهبرداری شد تا جلوی رد پیوند اعضا پس از عمل جراحی گرفته شود. خوشبختانه با موفقیتهای پیرامون پیوند مغز استخوان، از سلول درمانی به منظور بهبود وضعیت حال بیمار در بسیاری از بیماریهای مختلف خودایمنی و همچنین سرطان بیشتر استقبال شد.
تنظیمکنندههای دستگاه ایمنی
داروهایی در بحث ایمونوتراپی وجود دارد که بخشهایی از دستگاه ایمنی را تنظیم و حتی تقویت میکنند. مهارکنندههای چک پوینتی و سایتوکاینها از مهمترین تنظیمکنندههای دستگاه ایمنی به شمار میروند. تنظیمکنندههای ایمنی در سه نوع طبیعی، مصنوعی و نوترکیب وجود دارند.
ویروس درمانی انکولیتیک
ویروسهایی در محیط آزمایشگاه تغییر و تحول مییابند که میتوانند سلولهای سرطانی را بدون آسیب به سلولهای سالم مجاور، دچار عفونت کرده و سپس از بین ببرند. برخی از ویروسها در طبیعت وجود داشته، در حالیکه سایر ویروسها در یک محیط آزمایشگاهی تغییر و تحول مییابند.
چگونه ایمونوتراپی کار میکند؟
چند نوع مختلف از ایمونوتراپی وجود دارد که برای درمان سرطان مورد استفاده قرار میگیرد. دو نوع اصلی از آنها مهارکنندههای چک پوینت و ایمونوتراپی سلولی است.
بسیاری از ایمونوتراپیهای سرطان با تکیه بر فعالسازی سلولهای T عمل میکنند. سلولهای T اجزایی از دستگاه ایمنی محسوب میشوند که به مارکرهای مشخصِ سلولهای توموری متصل و به آنها حمله میکند. یک راه گریز برای سلولهای سرطانی از چنگ سلولهای T در این است که سیگنالهای اشتباه و جعلی متعددی را به سلول ایمنی چک پوینت ارسال کرده تا خودشان را بدون ضرر نشان دهند. به همین منظور، گروهی از داروهای شیمیایی به اسم مهارکنندههای چک پوینتِ ایمنی، تمامی این سیگنالهای جعلی را مسدود کرده تا دستگاه ایمنی فریب چنین تاکتیکی را از سمت سلولهای سرطانی نخورد.
سال ۲۰۱۸ میلادی، متخصص ایمونولوژی آمریکایی به نام جیمز آلیسون و تاسوکو هانجو، یک متخصص ایمونولوژی ژاپنی هر دو برای فعالیتهایشان به منظور توسعهی مهارکنندههای چک پوینتی، برندهی جایزهی نوبل شدند
این کشف به شدت در علوم پزشکی سر و صدا کرد که در سال ۲۰۱۸ میلادی، متخصص ایمونولوژی آمریکایی به نام جیمز آلیسون و تاسوکو هانجو، یک متخصص ایمونولوژی ژاپنی هر دو برای فعالیتهایشان به منظور توسعهی مهارکنندههای چک پوینتی، برندهی جایزهی نوبل شدند.
یک نوع دیگر از ایمونوتراپی، تحت عنوان ایمونوتراپی سلولی شناخته میشود. این نوع در واقع از ایدهی اسب تروجان برای غلبه بر بیماری سرطان بهره میبرد. سلولهای ایمنی از بدن فرد بیمار دریافت شده، در یک محیط آزمایشگاهی تغییر و تحول یافته و در نهایت مجدد به بدن بیمار در اندازهی بسیار زیاد برگردانده شده تا به دستگاه ایمنی برای مبارزه با سرطان کمک شود.
یک مثال در این زمینه، همانطور که قبلا هم به آن اشاره شد CAR T cell therapy است. در این پروسه، سلولهای T بیمار گرفته شده و یک ژن به اسم گیرندهی آنتیژنی کایمری (CAR) به آن اضافه میشود. زمانیکه سلولهای T تغییر یافته مجدد در بدن به عنوان سلولهای CAR T انتقال داده میشود، به اصطلاح این سلولها به شدت شارژ شده تا سلولهای سرطانی را شناسایی و سپس با آنها مبارزه کنند. این فرایند درمانی، به بزرگسالان و کودکان مبتلا به سرطانهای خونی نظیر لوکمیا و لنفوما یک امید جدید هدیه میدهد.
فواید ایمونوتراپی
به جز ایمونوتراپی، سایر روشهای درمانی و کمدردسرتر دیگری برای درمان سرطان وجود دارد. با این حال، یکی از مهمترین مزیتهای ایمونوتراپی، عوارض جانبی اندک آن است. از طرفی دیگر، ماندگاری آثار ایمونوتراپی در بدن فرد بیمار به مراتب بالاتر از سایر شیوههاست. حتی در برخی پروندههای پزشکی به این موضوع اشاره شده که بیمار به یک سرطان بسیار پیشرفته دچار شده اما با انجام ایمونوتراپی، تومورها به طور کامل نابود شدهاند.
شاید این سوال پیش بیاید که آیا میتوان از ایمونوتراپی به منظور مبارزه با سایر بیماریها به جز سرطان هم استفاده کرد یا خیر. در پاسخ باید گفت با اینکه هدف اصلی از انجام ایمونوتراپی، مبارزه با سلولهای سرطانی است، این فرایند درمانی همچنین برای درمان و بهبود وضعیت بیماری و اختلالهای خود ایمنی دیگر هم مورد استفاده قرار میگیرد. محققین در تلاش هستند تا از این فرایند درمانی برای اختلالهای ژنتیکی، عفونت و التهابها، دیابت، بیماریهای قلبی و عروقی و همچنین پزشکی ترمیمی هم بهره ببرند.
عوارض جانبی ایمونوتراپی
ایمونوتراپی نسبت به سایر روشهای درمانی از عوارض جانبی کمتری برخوردار است؛ چراکه در این روش، تنها دستگاه ایمنی بدن مورد هدف قرار گرفته و پروسهی درمانی روی سلولهای دستگاههای دیگر اثرگذار نیست. با این اوصاف همچنان عوارض جانبی متعددی را بیماران در حین پروسهی ایمونوتراپی گزارش کردهاند. این عوارض میتواند روی هر بافت یا اندامی داخل بدن اثرگذار باشد. همچنین وخامت عوارض جانبی میتواند از ملایم تا شدید هم باشد. در برخی از شرایط ممکن است آثار جانبی ایمونوتراپی جان بیمار را هم به خطر بیندازد.
اگر بتوان اختلال و عوارض جانبی ایمونوتراپی را در اسرع وقت متوجه شد، میتوان با روشهای متداول نظیر تجویز داروهای مختلف جلوی پیشرفت عوارض را گرفت. برای مثال در بسیاری از پروندهها داروهای سرکوبکنندهی ایمنی نظیر استروئیدها تجویز میشود. بنابراین، هر بیماری که ایمونوتراپی را تجربه میکند باید توسط پزشک به صورت دائمی رصد شود تا مبادا عوارض جانبی یا واکنشهایی نسبت به درمان، در بدن فرد بیمار بروز پیدا کند.
با وجود این که ایمونوتراپی در بسیاری از مواقع سودمند است، در برخی از انواع تومورها این روش کارایی لازم را ندارد؛ چراکه قرار نیست سرطانها دقیقا از لحظ فاکتورهای محیطی، زیستی و ژنتیکی دقیقا شبیه به یکدیگر باشند. بنابراین، ایمونوتراپی در افراد مختلف، پیامدهای مختلفی هم به دنبال دارد.
تحقیقات مهمی که پیرامون ایمونوتراپی تا به حال انجام شد
بسیاری از ایمونوتراپیها توسط سازمان غذا و داروی کشور ایالات متحدهی آمریکا (FDA) تایید شده و امروزه برای درمان سرطان و برخی دیگر از پروسههای درمانی مورد استفاده قرار میگیرند. اگرچه، تحقیقات بیشتری در سطح مولکولی نیاز است تا ساز و کار فعالیت دستگاه ایمنی به شیوهای عمیقتر فهمیده شود تا بلکه بتوان فرایندهای درمانی جدیدتری را ابداع کرد.
تلاشهای شبانهروزی دکتر فرنک فیچ در اواخر دههی ۱۹۸۰ میلادی موجب شد تا توانایی سلولهای T در کشتن سلولهای خطرناک توموری کشف شود. محققین دانشگاه شیکاگو در مرکز سرطان به این مسئله پی بردند که شاید دستگاه ایمنی بدن بتواند در ابتدا علیه تومورها از لحاظ دفاعی عملکرد خوبی از خود نشان دهد، اما این فرایند بعدها بنا به دلایلی متوقف میشود. به همین منظور، سلولهای سرطانی رشد میکنند. فرایندهای زیستی برای جلوگیری از بروز بیماریهای خودایمنی نظیر لوپوس یا آریتریت روماتید به شدت مورد نیاز است. چک شدن پاسخ ایمنی در بدن میتواند جلوی فرار سلولهای سرطانی را از سیستم دفاعی بدن هم بگیرد.
تلاشهای شبانهروزی دکتر فرنک فیچ در اواخر دههی ۱۹۸۰ میلادی موجب شد تا توانایی سلولهای T در کشتن سلولهای خطرناک توموری کشف شود
در بیش از دو دههی گذشته محققین شیکاگو واکسنهای سرطان را مورد آزمایش قرار دادهاند تا میزان سلولهای T وابسته به آنتیژن را افزایش دهند. این سلولها در حقیقت گلبول سفید خونِ خاصی هستند که میتوانند آنتیژنها یا بخش پروتئینی کوچکی را روی سطح برخی از سلولهای سرطانی کشف کنند. دانشمندان همچنین مشاهده کردهاند که برخی از مردم پیش از دریافت واکسن توانستهاند این سطح از سلولهای T را در خون خود به صورت بسیار بالا داشته باشند. به همین دلیل، واکسن روی برخی از انسانها موثر واقع نمیشود.
دانشمندان از برخی عوامل و فاکتورهای مختلف در پاسخ بیمار به ایمونوتراپی پردهبرداری کردهاند. توماس گجفسکی، پروفسور آسیبشناسی و پزشکی اخیرا یافته که باکتریهای رودهی یک انسان ممکن است روی برخی از ایمونوتراپیها تاثیرگذار باشد.
یکی دیگر از عوامل محیطی تومورها که نقش حیاتی دارد، محیط سلولی است که تومور در آنجا رشد میکند. محیط اطراف تومور شامل بافت، عروق خونی، سلولهای ایمنی، فیبروبلاستها و سایر اجزایی است که با سلولهای توموری در تعامل است. این اجزا نقش مهمی در رفتار تومور و همچنین میزان آسیبپذیریشان به برخی از داروها از خود نشان میدهند. گجفسکی از اصطلاحی به اسم محیط التهابی توموری سلولهای T به منظور توصیف یک گروه از تومورهای خاص در بیماران استفاده میکند که نسبت به ایمونوتراپی راحتتر پاسخ مثبت میدهند. در هر صورت، چه کم و چه زیاد، ایمونوتراپی میتواند تاثیر مثبتی روی حال بیماران داشته باشد.
آیا ایمونوتراپی واقعا در درمان بیماری موفق عمل میکند؟
سازمان FDA از اوایل سال ۲۰۱۷ میلادی، چهار داروی مهارکنندهی چک پوینتی را برای استفاده در ایمونوتراپی تایید کرد. با این حال جالب است بدانید که ایمونوتراپی برای سرطان از سال ۲۰۱۱ در کشورهای غربی به رسمیت شناخته شد. بیش از هفتاد داروی ایمونوتراپی برای مصارف بالینی در دست تولید قرار گرفته است. با پیشرفت و گسترش فرایند ایمونوتراپی، شرکتهای متعددی در حوزهی درمان سرطان در آمریکا تاسیس شد که سهام هر یک از این شرکتها بهایی بیش از صد میلیون دلار و حتی بیشتر دارند. با تمامی این تفاسیر، تنها ۱۵ الی ۲۰ درصد از بیماران میتوانند نتایج سودمند و مستمری را از بابت ایمونوتراپی کسب کنند. دانشمندان در تلاش هستند تا مارکرهای زیستی جدیدی را برای فهمِ بیشترِ ساز و کار دستگاه ایمنی بدن انسان کشف کنند. با وجود اینکه این مسئله یک فرایند بسیار پیچیده، هزینهبر و زمانبر است، میتوان آیندهی بهتری را برای حوزهی درمانی ایمونوتراپی تصور کرد.
منبع: chicago news

